Imagine que o envelhecimento cerebral não é apenas uma linha reta rumo ao declínio, mas uma curva sinuosa, cheia de desvios, curvas e até pontos críticos em que as coisas mudam de direção. A ciência, há décadas, persegue respostas para uma questão central: o que realmente impulsiona o envelhecimento do cérebro? Por que algumas pessoas mantêm a clareza mental até idades avançadas, enquanto outras perdem rapidamente funções cognitivas? E, mais instigante ainda: seria possível intervir nesse processo antes que o ponto de virada chegue — antes que as mudanças se tornem irreversíveis?
Comecei a pensar mais profundamente sobre isso depois de ler sobre um experimento simples: um grupo de pessoas de meia-idade tomou um suplemento que eleva os níveis de corpos cetônicos no sangue — e, surpreendentemente, os exames mostraram um efeito imediato de restauração da estabilidade das redes cerebrais. Esse efeito, porém, desapareceu nos idosos. A pergunta então ficou ecoando: existiria uma janela de tempo em que o cérebro é especialmente sensível a intervenções metabólicas?
Para explorar esse tema, preciso abrir um parêntese rápido e explicar dois conceitos técnicos essenciais. Primeiro, falo de “homeostase metabólica”, que é a capacidade do corpo (e do cérebro) de manter seus processos energéticos sob controle, mesmo diante de mudanças e desafios. Segundo, entra em cena o “transporte de glicose”, responsável por abastecer neurônios com sua principal fonte de energia. Mas, ao contrário do que se imagina, esse transporte não é igual para todos os neurônios — alguns dependem de mecanismos sensíveis à insulina, enquanto outros usam caminhos independentes. Aqui, o protagonista é o transportador GLUT4, que exige insulina para funcionar.
E por que isso importa? Porque, com a idade, a resistência à insulina aumenta silenciosamente em várias partes do corpo, inclusive no cérebro. Esse fenômeno é chamado de “resistência neuronal à insulina”. Neurônios resistentes à insulina simplesmente não conseguem absorver glicose de maneira eficiente, entrando em um estado de “hipometabolismo” — basicamente, um modo de economia forçada, com menos energia disponível para as tarefas do dia. O que a ciência começou a perceber é que essa queda no metabolismo antecede sintomas clínicos de doenças neurodegenerativas, como Alzheimer. O mais curioso é que, nessas fases iniciais, as mudanças já aparecem nos exames funcionais, como fMRI (ressonância magnética funcional) ou EEG (eletroencefalograma), muito antes de qualquer sintoma perceptível no cotidiano
.
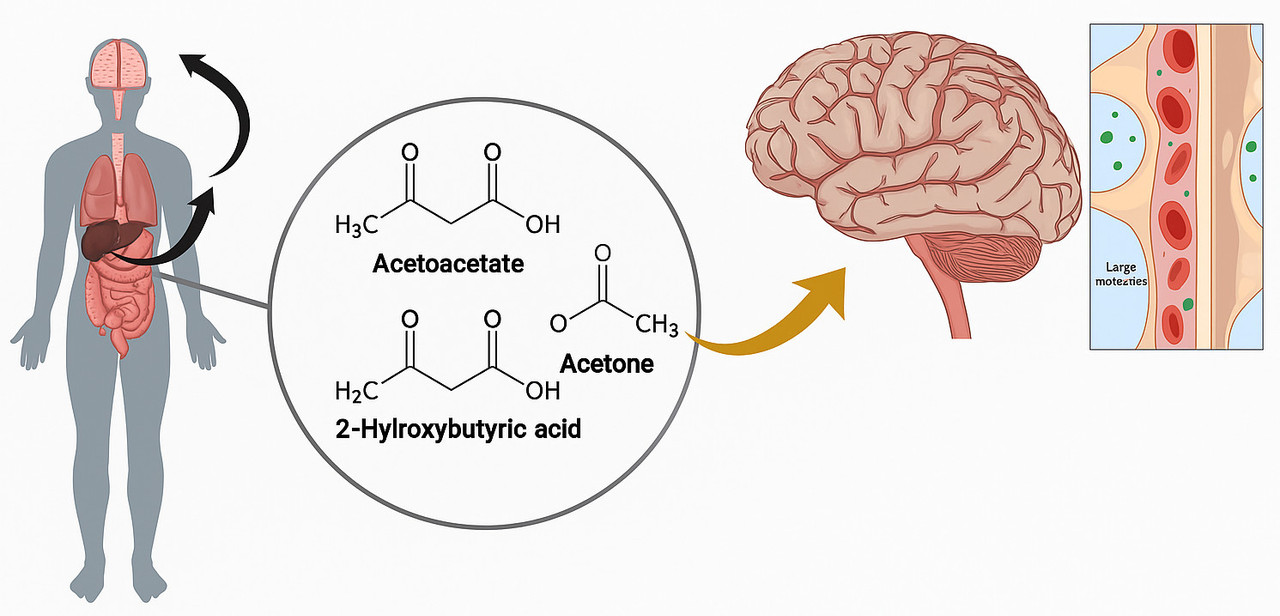
Talvez agora você esteja se perguntando: se o problema é a energia, não seria possível fornecer uma fonte alternativa? É aqui que entram os corpos cetônicos. Eles podem ser produzidos naturalmente pelo corpo durante o jejum ou dietas com baixo teor de carboidrato, ou ainda ser fornecidos em suplementos específicos. Os corpos cetônicos — como o beta-hidroxibutirato — conseguem alimentar os neurônios mesmo quando há resistência à insulina, porque usam um transportador chamado MCT2, que não depende de insulina para funcionar. É um atalho bioquímico, uma rota de fuga para o neurônio faminto.
Ao investigar o padrão do envelhecimento cerebral, pesquisadores descobriram algo fascinante: a trajetória não é linear, mas sim sigmoidal — lembra uma curva em “S”. Eles identificaram pontos críticos nessa curva, como o início da desestabilização das redes cerebrais por volta dos 43 a 47 anos, o ponto de máxima aceleração dessa instabilidade entre os 60 e 67 anos e, por fim, um platô, quando a rede já está bem menos estável. Esses marcos foram replicados em grandes bancos de dados populacionais, usando exames funcionais em dezenas de milhares de participantes, de jovens adultos a idosos. Nesses estudos, o aumento da instabilidade das redes cerebrais coincidiu de maneira impressionante com um aumento nos níveis de HbA1c — um marcador de glicemia cronicamente elevada, ligado à resistência à insulina. Interessante também perceber que, enquanto os marcadores metabólicos disparam já no início desse processo, os problemas vasculares e inflamatórios aparecem mais adiante, na curva.
A reflexão aqui é inevitável: muitos modelos antigos de envelhecimento sugeriam que tudo era uma mistura de pequenos desgastes acumulados, como oxidação, inflamação e lesão vascular. Agora, começa a emergir a ideia de que a quebra da homeostase metabólica — e especialmente da resposta à insulina nos neurônios — é o grande gatilho. Um lapso de memória (me distraí aqui, porque acabei pensando em quantas vezes já ouvi médicos falando do cérebro como “órgão consumidor de glicose”, mas quase nunca mencionando que esse consumo pode travar).
Quando os pesquisadores analisaram padrões de expressão gênica em diferentes regiões do cérebro, cruzando com o ritmo do envelhecimento funcional dessas áreas, encontraram uma correlação forte entre as regiões que envelhecem mais rápido e a presença do GLUT4. E, curiosamente, regiões com maior expressão de MCT2 (o transportador de corpos cetônicos) mostraram menos vulnerabilidade. Em outras palavras, parece que existe uma espécie de “escudo protetor” para os neurônios capazes de usar corpos cetônicos. O gene alelo apolipoproteína, conhecido por seu papel no transporte de lipídios e como fator de risco para Alzheimer, também apareceu nesse cenário — como se houvesse uma conversa entre metabolismo de glicose, lipídios e cetonas nos bastidores do envelhecimento cerebral.
Eu tive algumas reflexões, quase como quem tropeça numa ideia no meio do caminho. Se já sabemos que existe essa janela crítica entre os 40 e 60 anos, por que não existem políticas de saúde pública voltadas para intervenções metabólicas nessa faixa etária? Seria preciso esperar pelos primeiros sintomas de declínio ou poderíamos, de forma proativa, propor estratégias de prevenção baseadas em metabolismo cerebral? A própria experiência pessoal me faz pensar que a maioria das pessoas só se preocupa com dieta ou atividade física quando sente o peso do cansaço mental ou os lapsos de memória aumentam. Mas o corpo e o cérebro já estavam mudando muito antes disso.
Retomando a linha de raciocínio, há uma questão técnica que sempre gera discussão: como isolar o impacto do metabolismo do cérebro, sem confundir com fatores vasculares ou inflamatórios? Os estudos resolveram isso controlando rigorosamente as variáveis, usando grandes amostras e métodos de análise funcional que permitem separar os efeitos. Assim, foi possível mostrar que, no início do processo de envelhecimento cerebral, é o metabolismo que muda primeiro. Só depois vêm as alterações vasculares e, por fim, as inflamatórias.
Outro ponto curioso: na hora de testar intervenções com corpos cetônicos, os pesquisadores descobriram que o efeito positivo é maior justamente durante o período de transição metabólica, aquela janela entre os 40 e 59 anos. Depois dos 60, o benefício desaparece. Não porque o suplemento não chegue ao cérebro, mas porque os neurônios já perderam a capacidade de usá-lo de forma eficiente. Chega um ponto em que o sistema deixa de “curvar” e passa a “quebrar”. Essa analogia do "curvar antes de quebrar" é muito usada na engenharia, mas aqui encaixa perfeitamente: os neurônios suportam o estresse metabólico até certo limite; passado esse ponto, as alterações tornam-se irreversíveis.
Reforçando o ponto anterior, o estudo sugere que uma intervenção precoce — especialmente antes da perda irreversível dos neurônios — pode reverter boa parte da instabilidade das redes cerebrais. Em outras palavras, existe sim uma “janela de oportunidade”, mas ela não fica aberta para sempre.
O próximo passo é entender por que algumas pessoas atravessam essa janela sem grandes problemas, enquanto outras não. Seriam fatores genéticos, ambientais, estilo de vida, ou uma combinação de todos eles? A expressão do gene apolipoproteína, por exemplo, pode aumentar o risco de declínio cognitivo acelerado, mas só em alguns contextos. O ambiente alimentar e a frequência de picos glicêmicos ao longo da vida provavelmente modulam essa vulnerabilidade.
A reflexão que faço agora é: quantos de nós paramos para pensar que as escolhas alimentares do cotidiano — excesso de açúcar, picos de insulina, falta de jejum metabólico — podem estar “programando” nosso cérebro para envelhecer mais rápido? Talvez a resposta não esteja em medicamentos caros, mas em estratégias simples de manutenção do metabolismo cerebral, como períodos de restrição alimentar, maior consumo de gorduras saudáveis, e até mesmo, em alguns casos, o uso planejado de suplementos cetônicos.
Voltando à ciência, há um desafio metodológico importante. Grande parte dos estudos anteriores analisava pessoas já com sintomas ou diagnóstico de doenças neurodegenerativas. Isso limita a capacidade de diferenciar causas de consequências. Quando o foco se volta para adultos saudáveis, principalmente antes dos 60 anos, torna-se possível enxergar o processo de envelhecimento como algo dinâmico, cheio de idas e vindas, e não como uma sentença inevitável. E, sim, os métodos de análise funcional do cérebro — como a estabilidade das redes neurais — podem indicar alterações anos antes do surgimento dos sintomas clássicos.
Uma questão que é bom destacar é a interação entre metabolismo, inflamação e função vascular. Esses sistemas não operam isoladamente. O envelhecimento acelera ciclos de retroalimentação negativa, em que o metabolismo prejudicado agrava a inflamação, que, por sua vez, compromete os vasos sanguíneos, criando um círculo vicioso. O grande problema é interromper esse ciclo no ponto certo, antes que o dano se torne permanente. Isso reforça a importância de intervenções multifatoriais, mas sem perder o foco: atacar o metabolismo pode ser a chave inicial para evitar o desmoronamento dos demais sistemas.
Ao juntar todas essas peças, fica claro que o envelhecimento cerebral é menos uma sequência de eventos previsíveis e mais um processo de transições abruptas, marcadas por pontos críticos. Entender e reconhecer esses pontos pode nos dar a chance de agir antes que seja tarde demais. E, embora eu me pegue repetindo essa ideia, talvez por insegurança ou insistência, não custa lembrar: o futuro das estratégias para manter o cérebro saudável talvez esteja menos em intervenções tardias e mais na identificação precoce da janela crítica de intervenção metabólica. Pensar nisso é, de certo modo, cuidar do próprio futuro.
Referências:
Discrete brain areas express the insulin-responsive glucose transporter GLUT4 - Áreas cerebrais discretas expressam o transportador de glicose sensível à insulina GLUT4: Esse estudo mapeou regiões específicas do cérebro que expressam o GLUT4, sugerindo que certos neurônios dependem diretamente da insulina para absorver glicose, o que os torna mais vulneráveis ao declínio metabólico com o envelhecimento. https://pubmed.ncbi.nlm.nih.gov/8737666/
Immunocytochemical localization of the insulin-responsive glucose transporter 4 (Glut4) in the rat central nervous system - Localização imunocitoquímica do transportador de glicose 4 (GLUT4), sensível à insulina, no sistema nervoso central de ratos: Este trabalho mostra que o GLUT4 está presente em diversas áreas do cérebro de ratos, reforçando a ideia de que a captação de glicose por neurônios pode depender da sensibilidade à insulina — um ponto central na hipótese da “diabetes tipo 3” no Alzheimer. https://pubmed.ncbi.nlm.nih.gov/9741479/
Brain fuel metabolism, aging, and Alzheimer's disease - Metabolismo energético cerebral, envelhecimento e doença de Alzheimer: O artigo revisa como o declínio na capacidade do cérebro de utilizar glicose precede sintomas de Alzheimer e discute o potencial uso terapêutico de fontes alternativas de energia, como corpos cetônicos, para retardar o envelhecimento cerebral. https://pubmed.ncbi.nlm.nih.gov/21035308/
Use of Functional Magnetic Resonance Imaging in the Early Identification of Alzheimer’s Disease - Uso da ressonância magnética funcional na identificação precoce da doença de Alzheimer: A fMRI é apresentada como uma ferramenta promissora para detectar alterações na conectividade cerebral antes mesmo do surgimento de sintomas clínicos — uma base importante para estudar como a instabilidade das redes cerebrais pode sinalizar o início do declínio cognitivo. https://pmc.ncbi.nlm.nih.gov/articles/PMC2084460/
The potential of functional MRI as a biomarker in early Alzheimer’s disease - O potencial da fMRI como biomarcador na fase inicial da doença de Alzheimer: Explora como a instabilidade funcional em redes cerebrais específicas pode servir como um marcador precoce e confiável da progressão do Alzheimer — tema que também aparece nos estudos sobre intervenção com cetose em fases críticas da meia-idade. https://pmc.ncbi.nlm.nih.gov/articles/PMC3233699/
Ketosis regulates K+ ion channels, strengthening brain-wide signaling disrupted by age Open Access - A cetose regula canais de íons K⁺, fortalecendo a sinalização cerebral ampla prejudicada pela idade: Um estudo inovador que mostra como corpos cetônicos restauram a função neuronal ao reequilibrar canais iônicos fundamentais para a sincronia em larga escala das redes neurais — sugerindo um mecanismo celular para o “escudo protetor” contra o envelhecimento cerebral. https://direct.mit.edu/imag/article/doi/10.1162/imag_a_00163/120749/Ketosis-regulates-K-ion-channels-strengthening
D-β-hydroxybutyrate stabilizes hippocampal CA3-CA1 circuit during acute insulin resistance - O D-β-hidroxibutirato estabiliza o circuito CA3-CA1 do hipocampo durante resistência aguda à insulina: Mostra como a presença de corpos cetônicos estabiliza as conexões neurais mesmo sob condições de resistência à insulina, explicando por que regiões que usam cetonas — via transportadores como o MCT2 — apresentam maior resiliência no envelhecimento. https://pubmed.ncbi.nlm.nih.gov/37662316/
Gene dose of apolipoprotein E type 4 allele and the risk of Alzheimer's disease in late onset families - Dose gênica do alelo tipo 4 da apolipoproteína E e o risco de Alzheimer em famílias com início tardio: Um dos estudos clássicos que estabelecem a associação entre o gene APOE4 e maior risco de Alzheimer, indicando um elo genético entre metabolismo lipídico e neurodegeneração — peça-chave na “conversa metabólica” entre glicose, lipídios e cetonas no cérebro que envelhece. https://pubmed.ncbi.nlm.nih.gov/8346443/



0 comments:
Postar um comentário