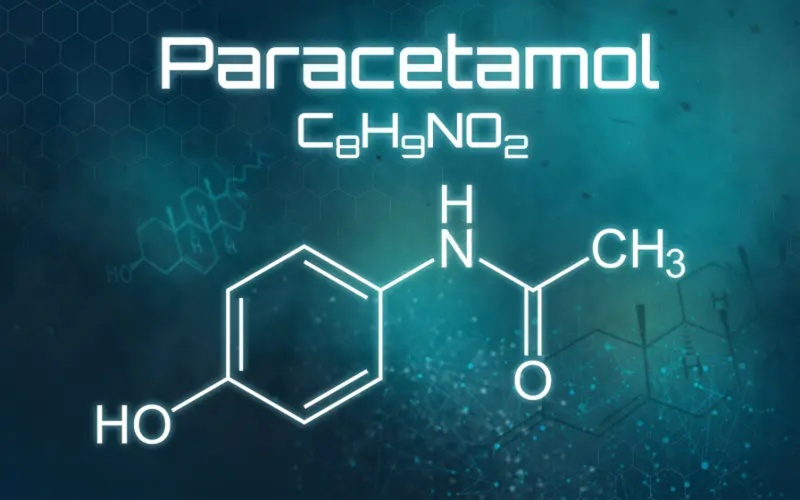
Começo com uma pergunta que talvez nunca tenha atravessado sua cabeça durante uma dor de cabeça banal: o que acontece se uma molécula tão cotidiana como o paracetamol encontra um embrião nas primeiras horas de vida, quando tudo o que existe é um punhado de células tentando se duplicar no tempo certo? Um estudo experimental recente abriu uma janela incômoda sobre esse encontro e apontou um mecanismo biológico simples, porém decisivo: o fármaco pode desacelerar o ciclo celular logo no início do desenvolvimento, reduzindo a síntese de DNA e travando as divisões que deveriam avançar com precisão de relógio.
Para entender por que esse achado chama atenção, vale situar a cena. A etapa de pré-implantação (período entre a fecundação e o momento em que o embrião se fixa no endométrio) é um corredor estreito do desenvolvimento humano. Em poucos dias, o zigoto passa por clivagens sucessivas, vira mórula e então blastocisto, uma esfera com duas populações celulares: a massa celular interna (ICM, do inglês inner cell mass), que dará origem ao feto, e o trofectoderma (TE), que formará a interface com o útero e parte das membranas. Cada divisão precisa acontecer com ritmo e qualidade. Pequenos atrasos, acúmulos de dano ou desbalanceamento entre ICM e TE podem significar um fim silencioso para aquela gestação, antes mesmo de uma menstruação atrasar.
Num cenário ideal, a escolha analgésica durante a tentativa de engravidar deveria ser trivial, quase um detalhe. Só que o paracetamol está por toda parte: é vendido sem receita, integra centenas de formulações e é amplamente usado por mulheres em idade reprodutiva. Exatamente por ser percebido como “leve”, sua presença discreta no cotidiano pode se somar a uma coincidência biológica: o embrião muito jovem é, em essência, uma máquina de copiar DNA. Perturbar esse processo por algumas horas pode ter um impacto desproporcional.
O trabalho que inspira esta análise não ficou apenas em cultura de uma linhagem celular e um gráfico elegante. A equipe percorreu vários níveis de complexidade: leveduras (Schizosaccharomyces pombe) como sistema vivo simples para testar hipóteses de mecanismo; células humanas em cultura, incluindo células embrionárias pluripotentes; embriões de camundongo expostos ex vivo a concentrações crescentes; embriões humanos descartados de tratamentos de fertilidade, monitorados por time-lapse; e, em paralelo, medições de paracetamol em fluidos reprodutivos de mulheres após dose analgésica padrão. A força do desenho não está em um número colossal por braço, e sim na repetição de um padrão biológico ao cruzar espécies, modelos e técnicas.
Qual seria o alvo central? A pista surge de uma enzima antiga e essencial: a ribonucleotídeo redutase (RNR). Ela converte ribonucleotídeos em desoxirribonucleotídeos, os tijolos do DNA. Sem RNR funcionando direito, a célula entra em estresse replicativo: tenta copiar o genoma, mas a matéria-prima falta, as forquilhas de replicação emperram e o ciclo acumula células na fase S (fase do ciclo celular em que o DNA é duplicado). Em leveduras, que não contam com os alvos clássicos do paracetamol (como COX-1/COX-2), a exposição à molécula reduziu a proliferação e gerou um perfil compatível com bloqueio de RNR. Quando os pesquisadores colocaram a versão “humanizada” da RNR nas leveduras, a sensibilidade ao fármaco aumentou, reforçando que o nó pode estar exatamente aí: menos desoxirribonucleotídeo, menos DNA novo, menos células filhas.
Se isso fosse apenas uma curiosidade de microrganismo, pouco mudaria nossa prática. Então o teste avança para células humanas. Em HEK293 (rim embrionário humano) e em células-tronco embrionárias (linhagens H1 e HUES4), uma exposição de poucas dezenas a centenas de micromolar não matou as células, mas diminuiu o número total ao longo do tempo e acumulou a população na fase S, exatamente como se a replicação tivesse perdido a fluidez. A síntese de DNA, medida por incorporação de EdU (um análogo de nucleosídeo que marca DNA recém-sintetizado), caiu. O padrão se repetiu: não era necrose difusa; era replicação mais lenta. E isso é o que mais importa num embrião.
A etapa seguinte foi colocar o efeito no contexto do desenvolvimento. Embriões de camundongo em estágio de duas células foram expostos por 24 a 48 horas a concentrações que iam de 10 a 200 µM. Enquanto controles avançavam para blastocisto com o número esperado de blastômeros (células resultantes das clivagens iniciais), os embriões expostos passaram a estacionar em estágios mais precoces, com menos células e menor taxa de blastocisto. Quando já eram blastocistos e recebiam o fármaco por 24 horas, o total de células até podia se manter, mas a ICM encolhia de forma dose-dependente, um detalhe crítico, porque a ICM é o núcleo do projeto fetal. Reduzir essa pequena população pode comprometer tudo que virá depois.
E quanto aos embriões humanos? Em laboratório, blastocistos e embriões em clivagem expostos por poucas horas a 100–200 µM mostraram diminuição de síntese de DNA e menor número de células após o período de cultura. Tem um detalhe anatômico que ajuda a visualizar: em blastocistos saudáveis, a ICM forma um grupamento claro de células que expressam marcadores como OCT3/4 (associado à pluripotência), enquanto o TE expressa CDX2. Com a droga, essa organização fica mais pobre, às vezes com a ICM menos definida. Não é um colapso súbito, como um botão off; é mais parecido com uma embreagem patinando: a máquina tenta andar, mas não entrega a mesma força.
Talvez você esteja pensando: “ok, mas essas concentrações fazem sentido no mundo real?” É uma pergunta justa. O estudo mediu paracetamol em fluido folicular, endométrio e líquido uterino de mulheres que receberam 1 g como analgesia em procedimentos ginecológicos. Achou níveis detectáveis nesses compartimentos perto do período em que um embrião naturalmente trafegaria. Outras referências apontadas pelos autores indicam que exposições padrão podem levar a concentrações plasmáticas acima de 100 µM, o que deixa a janela de plausibilidade aberta: as doses clínicas não estão a oceanos de distância do que causa atraso replicativo in vitro. Não se trata de dizer que tomar um comprimido inviabiliza uma gestação; a leitura sensata é que a margem de segurança pode ser mais estreita do que supúnhamos para um tecido em rápida divisão.
Outro pedaço do quebra-cabeça é metabolismo. Em cultura, após 72 horas com 500 µM, o meio apresentava majoritariamente o próprio paracetamol e seu conjugado sulfato. O metabólito NAPQI, famoso por ser o vilão nas hepatotoxicidades por superdosagem, não apareceu como protagonista nesse contexto. Isso reforça a ideia de um efeito direto da molécula-mãe, potencialmente interferindo no sítio radical da subunidade β da RNR, onde um radical tirosila e um centro di-férrico participam da química que mantém a enzima ativa. É um detalhe bioquímico, mas ele dá coerência ao quadro: se não é morte celular tóxica, e sim freio replicativo, o alvo enzimático faz sentido.
O estudo também olhou a gestação de camundongos sob exposição repetida ao paracetamol por via oral durante a janela de acasalamento e início da gestação. O desfecho foi avaliado no fim da prenhez, com contagem de fetos e de reabsorções (sinais de perda embrionária). Embora detalhes estatísticos finos dependam da leitura das tabelas, a direção dos resultados aponta para impacto reprodutivo quando a exposição ocorre nesse período crítico. A mensagem que emerge no conjunto é que pequenas diferenças na velocidade de divisão no começo podem se traduzir, lá adiante, em menos implantações bem-sucedidas.
Vale a pena reforçar o ponto-chave: quando o tecido alvo é altamente proliferativo e nada é mais proliferativo do que um embrião nos primeiros dias, qualquer molécula que mexa com a disponibilidade de desoxirribonucleotídeos ou com o tempo de passagem pela fase S pode deslocar a balança. O paracetamol não é uma “droga antiproliferativa” no uso cotidiano, é um analgésico e antipirético. Só que o contexto biológico muda o significado farmacológico. A mesma propriedade que parece irrelevante num fígado saudável pode ganhar peso desproporcional quando o alvo involuntário é um aglomerado de células recém-nascidas.
Evidentemente, existem limitações. O número de embriões humanos em clivagem disponíveis para experimento é pequeno; mesmo com blastocistos em maior quantidade, continua sendo um recorte. Exposições in vitro controlam variáveis que a vida real mistura, fluxo sanguíneo, farmacocinética, tempos de pico, efeitos compensatórios. Associação clínica direta entre uso de paracetamol e perda embrionária precoce exige coortes prospectivas e um desenho epidemiológico que considere confusão por indicação (por que a paciente tomou o remédio?), outras exposições concomitantes e diferenças individuais de metabolismo. O estudo não tenta pular essas etapas; ele descreve um mecanismo, mostra que concentrações plausíveis fazem diferença, e sugere com sobriedade que vale investigar mais.
O paracetamol é onipresente em rios e águas superficiais em vários países, e a exposição de fundo já foi detectada em populações europeias. Isso não significa que há risco imediato a embriões humanos a partir de traços ambientais; significa, isso sim, que vivemos cercados por uma molécula que circula nos nossos sistemas biológicos, às vezes sem que percebamos. Quando se fala de janela de vulnerabilidade biológica, dose e tempo se tornam tão relevantes quanto a identidade da substância. Uma dose única no momento errado pode ser mais impactante do que várias doses em um período indiferente do ciclo reprodutivo.
Você pode perguntar: o que uma pessoa tentando engravidar faz com essa informação? A resposta razoável é prudência informada. Não é necessário demonizar um analgésico útil; dá para reduzir uso desnecessário, evitar automedicação nos dias de maior chance de concepção e, principalmente, conversar com o médico sobre alternativas e estratégias de manejo da dor e febre nesse período. Doses, intervalos e necessidade real de cada tomada importam. Às vezes, uma compressa fria, hidratação e repouso resolvem uma cefaleia transitória que você medicaria por reflexo.
O mesmo raciocínio vale para febre, uma condição que, por si só, pode ser indesejada durante a concepção e início da gestação. Fazer o balanço risco-benefício com o profissional de saúde ajuda a manter o controle térmico sem expor o embrião a picos desnecessários de qualquer substância. E se o paracetamol for a escolha, pensar “menos é mais” quando possível, dentro do que é clinicamente adequado, parece sensato.
Há um elemento técnico que merece ser repetido, justamente para fixar a ideia: o alvo proposto — a RNR — é conservado de leveduras a humanos. Isso explica por que o padrão apareceu em tantos modelos, e também por que a fase S virou um ponto de convergência dos resultados. Em linguagem simples, o paracetamol passou a régua onde a célula mais precisava de fluidez. Quando o tecido é o embrião, esse pequeno desacerto de timing pode somar-se a outras variáveis e empurrar o sistema para um desfecho pior. Guardar esse mapa mental ajuda a interpretar futuras pesquisas e notícias sobre o tema.
Outro aspecto didático: o estudo observou que, em blastocistos expostos, a ICM tende a ficar menor. Faz sentido biológico. A ICM é um núcleo de pluripotência que precisa de massa mínima para sustentar diferenciações subsequentes. Um déficit inicial pode reverberar em organogênese e até em eixos como gônadas e sistema nervoso, que têm janelas temporais delicadas. Isso não é uma profecia sobre malformações a partir de uma dose isolada; é uma hipótese plausível que justifica vigiar com lupa possível impacto de exposições repetidas ou de picos coincidindo com dias críticos.
Estamos falando de ciência em andamento. Resultados como esses, quando chegam ao debate público, costumam provocar extremos: “é seguro, sempre foi” de um lado; “é perigoso, não use nunca” do outro. A postura mais útil fica no meio: evidência mecanística consistente somada a indícios de exposição plausível pedem estudos clínicos bem desenhados. Enquanto eles não chegam, dá para ajustar comportamento com leveza: evitar “toma e vê”; registrar quando e por que tomou; considerar analgésicos alternativos se aconselhados pelo médico; priorizar medidas não farmacológicas para dores triviais.
Pergunte a si mesmo: eu preciso mesmo desse comprimido hoje? Se a resposta for sim e muitas vezes será, tome dentro do intervalo terapêutico e com acompanhamento. Se a resposta for “talvez”, existem caminhos que não passam por uma molécula que, em um contexto muito específico, mostrou capacidade de travar a duplicação do DNA por horas. No começo da vida, horas contam.
Antes de encerrar, deixo um lembrete central: o estudo não propõe pânico, propõe atenção. Ele não diz que toda exposição levará a perda embrionária; demonstra que o mecanismo existe, que aparece cedo, que se reproduz em sistemas diferentes e que dialoga com níveis observados no trato reprodutivo após dose clínica comum. Esse conjunto, por si só, já muda a qualidade da conversa entre quem tenta engravidar e quem orienta o cuidado.
Em ciência, um resultado vale pelo que explica e pelo que permite perguntar. Aqui, as perguntas que ficam são claras. Quais são as janelas de maior vulnerabilidade durante o ciclo? Há diferenças individuais de metabolismo que amplifiquem ou atenuem o efeito? Como febre, estresse e outras medicações modulam o quadro? O que os dados de coorte dirão quando acompanharmos tentantes com um diário de uso real e marcadores hormonais? Enquanto essas respostas chegam, a mensagem prática é simples: informação, parcimônia, diálogo clínico, três ferramentas baratas que protegem decisões em períodos em que cada detalhe pode pesar.
Referência:
Paracetamol (N-acetyl-para-aminophenol) disrupts early embryogenesis by cell cycle inhibition - Uma porcentagem considerável de concepções humanas são perdidas antes do nascimento ( Roberts e Lowe, 1975 ; Wilcox et al. , 1988 ). Dados das últimas décadas mostraram que cerca de 10–40% de todos os embriões não conseguem se implantar, e mais 10% das gestações provavelmente são perdidas após a implantação, mas antes do reconhecimento clínico ( Roberts e Lowe, 1975 ; Wilcox et al. , 1988 , 1999 ; Zinaman et al. , 1996 ; Wang et al. , 2003 ; Jarvis, 2016a , b ; Foo et al. , 2020 ; Muter et al. , 2023 ). Estudos genéticos pré-implantação indicaram que anormalidades cromossômicas como aneuploidia contribuem para cerca de 50% da perda peri-implantação ( Yang et al. , 2012 ; Iwasa et al. , 2023 ), indicando que fatores ambientais desempenham um papel na perda de gestações precoces ( Regan e Rai, 2000 ; Brown, 2008 ). https://academic.oup.com/humrep/advance-article/doi/10.1093/humrep/deaf116/8234396



0 comments:
Postar um comentário